Periodsäure
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
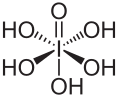 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Periodsäure | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | H5IO6 | |||||||||||||||
| Kurzbeschreibung | farbloser, fast geruchloser Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 227,95 g·mol−1 | |||||||||||||||
| Aggregatzustand | fest | |||||||||||||||
| Schmelzpunkt | 122 °C[1] | |||||||||||||||
| Siedepunkt | Zersetzung bei 130–140 °C[1] | |||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Periodsäure, auch Perjodsäure, ist eine Säure des Elements Iod. Ihre Salze heißen Periodate und können als Oxidationsmittel beispielsweise in organischen Synthesen dienen.
Eigenschaften
Die Verbindung ist als Orthoperiodsäure (H5IO6) die einzige in Wasser beständige Iod(VII)-Säure.
Sie ist ein starkes Oxidationsmittel und eine schwache mehrbasige Säure mit einem pKs-Wert von 3,29.[3]
Orthoperiodsäure kristallisiert monoklin, Raumgruppe P21/n (Raumgruppen-Nr. 14, Stellung 2)Vorlage:Raumgruppe/14.2, mit den Gitterparametern a = 5,28 Å, b = 18,35 Å, c = 4,95 Å und β = 111,4°.[4] Sie hat eine nahezu oktaedrische Struktur, wobei die Doppelbindung zum Sauerstoff mehr Platz beansprucht und damit eine Ligandenebene etwas eindrückt. Es ergeben sich Winkel von unter 90° zwischen den Liganden.
Beim Erhitzen im Vakuum bildet sich durch fortgesetzte Kondensationsreaktionen über oligo-Periodsäuren, beispielsweise die Triperiodsäure (H7I3O14), die polymere meta-Periodsäure ((HIO4)n). In den oligo-Periodsäuren und der meta-Periodsäure ist das Iod verzerrt oktaedrisch von Sauerstoffatomen umgeben. Die Oktaeder sind jeweils über zwei Ecken miteinander verknüpft.[5]
-
 Strukturformel von Triperiodsäure
Strukturformel von Triperiodsäure -
 Struktur der meta-Periodsäure
Struktur der meta-Periodsäure
Herstellung
Orthoperiodsäure wird aus Bariumorthoperiodat und Salpetersäure hergestellt. Man macht sich zunutze, dass Bariumnitrat in Salpetersäure unlöslich ist.[6]
Die Anodische Oxidation von Iodsäure führt ebenfalls zur Periodsäure.[7]
Verwendung
- Malaprade-Reaktion (Glycolspaltung)
- PAS-Reaktion
Einzelnachweise
- ↑ a b c d e f Datenblatt Periodsäure zur Synthese bei Merck, abgerufen am 10. November 2021.
- ↑ a b Eintrag zu Periodsäure. In: Römpp Online. Georg Thieme Verlag, abgerufen am 14. Juli 2014.
- ↑ Cotton-Wilkinson: Anorganische Chemie, 3. Auflage, Verlag Chemie, Weinheim 1974, ISBN 3-527-25503-6.
- ↑ Y.D. Feikema: The Crystal Structures of Two Oxy-Acids of Iodine. I. A Study of Orthoperiodic Acid, H5IO6, by Neutron Diffraction. In: Acta Crystallographica, 20, 1966, S. 765–769, doi:10.1107/S0365110X66001828.
- ↑ Holleman/Wiberg: Anorganische Chemie, 103. Auflage, Band 1: Grundlagen und Hauptgruppenelemente, de Gruyter, 2017, ISBN 978-3-11-026932-1.
- ↑ G. Brauer (Hrsg.): Handbook of Preparative Inorganic Chemistry, 2nd ed., Vol. 1, Academic Press 1963, S. 322–323.
- ↑ Periodsäure. In: Spektrum der Wissenschaft. Abgerufen am 19. Februar 2024.













