Xenonsäure
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
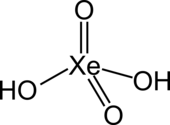 | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Xenonsäure | ||||||||||||
| Summenformel | H2XeO4 | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 197,31 g·mol−1 | ||||||||||||
| pKS-Wert | 10,5[1] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Xenonsäure ist eine Säure des Edelgases Xenon. Ihre Salze sind die Xenate XeO42− und die Hydrogenxenate HXeO4−. Ihre Existenz wurde von Linus Pauling vorhergesagt.[3]
Gewinnung und Darstellung
Xenonsäure kann durch Hydrolyse von Xenon(VI)-oxid XeO3 hergestellt werden, wobei nur ein kleiner Teil zur Säure reagiert.[1]
Eigenschaften
Xenonsäure ist ein starkes Oxidationsmittel. In saurer Lösung ist es in der Lage Iod schnell zu oxidieren.[4] Die wässrige Lösung ist nur schwach sauer.[1] In freier Form ist sie nicht bekannt.[5]
Durch Zugabe einer Base zu Xenon(VI)-oxid bildet sich das Hydrogenxenat-Ion HXeO4−:
Die Disproportionierung des Hydrogenxenat-Ion lässt das Perxenat-Ion XeO64− entstehen.[1][6]
Einzelnachweise
- ↑ a b c d A. F. Holleman, Egon Wiberg, Nils Wiberg: Inorganic Chemistry. Hrsg.: Nils Wiberg. Academic Press, 2001, ISBN 0-12-352651-5, S. 399.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Linus Pauling: The Formulas of Antimonic acid and the Antimonates. J. Am. Chem. Soc., 1933, S. 1895–1900, doi:10.1021/ja01332a016.
- ↑ Howard H. Claassen: The Noble Gases. Heath, 1966, S. 65.
- ↑ Peter Paetzold: Chemie: Eine Einführung. Walter de Gruyter, 2009, ISBN 978-3-11-021135-1, S. 695 (books.google.com).
- ↑ David W. Oxtoby, Wade A. Freeman, Toby F. Block: Chemistry 4th Edition. ISBN 0-03-033188-9, Kap. 4, S. 87AP.













