Transposición de Ferrier
La Transposición de Ferrier es una reacción orgánica que implica una reacción de sustitución nucleofílica combinada con una transposición alílica de un glical (un glucósido 2,3-insaturado). Fue descubierta por el químico Robert J. Ferrier.[1][2]

Mecanismo
En el primer paso, se forma un catión aliloxocarbenio (2) como intermediario, típicamente promovido por un Lewis ácido como cloruro de indio (III) o trifluoruro de boro. Este ion reacciona in situ con un alcohol, formando una mezcla de anómeros α (3) y β (4) del 2-glucósido. La doble ligadura se estabiliza por resonancia en las posiciones 3,4.[3]
Ejemplos
| Ácido de Lewis | Alcohol | Condiciones | Resultados |
|---|---|---|---|
| InCl3 | Metanol | En diclorometano | α:β = 7:1[4] |
| dioxano | Agua | Calefacción | 75% rendimiento[5] |
| SnCl4 | Metanol | En diclorometano, –78 °C, 10 min | 83% rendimiento, α:β = 86:14[6] |
| BF3·O(C2H5)2 | isopropanol | En diclorometano, TA, 24 h | 95% rendimiento[7][8] |
| ZnCl2 | Etanol | En tolueno, RT, 30@–60 min | 65–95% rendimiento, α:β = 89:11[9][10] |
| BF3·O(C2H5)2 | Alcohol bencílico | En diclorometano, –20 °C a TA, 1 h | 98% cosecha[11] |
Modificaciones
Formación de C-glucósidos
Reemplazando el alcohol con un silano, se pueden formar por este método los C-glucósidos. Con trietilsilano (R'=H), la reacción forma un 2,3-deoxy azúcar insaturado.[12]

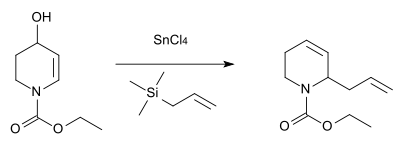
Equivalente de nitrógeno
Una reacción análoga con nitrógeno como heteroátomo fue descrits en 1984 para la síntesis del antibiótico estreptazolina.[13]
Referencias
- ↑ «Unsaturated Carbohydrates. Part 21. A Carboxylic Ring Closure of a Hex-5-enopyranoside Derivative». J. Chem. Soc., Perkin Trans. 1: 1455-1458. 1979. doi:10.1039/P19790001455.
- ↑ Ferrier, Robert J.; Zubkov, O. A. (2003). «Transformation of Glycals into 2,3-Unsaturated Glycosyl Derivatives». Org. React. 62. ISBN 0-471-26418-0. doi:10.1002/0471264180.or062.04.
- ↑ Konstantinović, Stanimir (2001). «The Ferrier rearrangement as the key step in the synthesis of C7–C16-alkyl 2,3-dideoxy glucosides from glucose and C7–C16-alkanols». J.Serb.Chem.Soc. 66 (8): 499-505.
- ↑ «Indium trichloride catalyzed Ferrier rearrangement – facile synthesis of 2,3-unsaturated glycosides». Arkivoc: 87-102. 2004.
- ↑ «4,6-Di-O-acetyl-aldehydo-2,3-dideoxy-D-erythro-trans-hex-2-enose. Probable reason for the 'al' in Emil Fischer's triacetyl glucal». J. Am. Chem. Soc. 92 (17): 5288-5290. 1970. doi:10.1021/ja00720a087.
- ↑ «Simple Designs for the Construction of Complex trans-Fused Polyether Toxin Frameworks. A Linear Strategy Based on Entropically Favored Oxirane Ring Enlargement in Epoxycycloalkenes Followed by Carbon-Carbon or Carbon-Oxygen Bond-Forming Cyclizations». J. Org. Chem. 59 (10): 2848. 1994. doi:10.1021/jo00089a034.
- ↑ Ferrier, R. J.; Prasad, N. (1969). «Unsaturated carbohydrates. Part IX. Synthesis of 2,3-dideoxy-α-D-erythro-hex-2-enopyranosides from tri-O-acetyl-D-glucal». Journal of the Chemical Society C Organic (4): 570. doi:10.1039/J39690000570.
- ↑ Ferrier, R. J.; Prasad, N. (1969). «Unsaturated carbohydrates. Part X. Epoxidations and hydroxylations of 2,3-dideoxy-α-D-hex-2-enopyranosides. The four methyl 4,6-di-O-acetyl-2,3-anhydro-α-D-hexopyranosides». Journal of the Chemical Society C Organic (4): 575. doi:10.1039/J39690000575.
- ↑ Kelly, David R.; Picton, Mark R. (2000). «Catalytic tin radical mediated tricyclisations. Part 1. Monocyclisation studies». Journal of the Chemical Society Perkin Transactions 1 (10): 1559. doi:10.1039/b000661k.
- ↑ Kelly, David R.; Picton, Mark R. (2000). «Catalytic tin radical mediated tricyclisations. Part 2.». Journal of the Chemical Society Perkin Transactions 1 (10): 1571. doi:10.1039/b000662i.
- ↑ Donohoe, Timothy J.; Blades, Kevin; Helliwell, Madeleine (1999). «Synthesis of amino-sugars using the directed dihydroxylation reaction». Chemical Communications (17): 1733. doi:10.1039/a904991f.
- ↑ Konstantinović, Stanimir (2001). «The Ferrier rearrangement as the key step in the synthesis of C7–C16-alkyl 2,3-dideoxy glucosides from glucose and C7–C16-alkanols». J.Serb.Chem.Soc. 66 (8): 499-505.
- ↑ Kozikowski, AP, Pyeong-uk Park (1984). «Synthesis of 2-substituted .DELTA.3-piperidines: the nitrogen analog of the Ferrier rearrangement. An approach to streptazolin». J. Org. Chem. 49 (9): 1674-1676. doi:10.1021/jo00183a044.
 Datos: Q5445348
Datos: Q5445348 Multimedia: Ferrier rearrangement / Q5445348
Multimedia: Ferrier rearrangement / Q5445348








