Réarrangement de Hofmann
Le réarrangement de Hofmann est une réaction organique qui transforme un amide primaire non substitué ,par action d'ion hypobromite ou hypochlorite ,en amine primaire avec une chaine carbonée plus courte d'un atome[1],[2],[3].
Cette réaction est nommée d'après son découvreur, le chimiste allemand August Wilhelm von Hofmann. Elle est parfois aussi nommée « dégradation de Hofmann », mais ne doit pas être confondue avec l'élimination de Hofmann.
Mécanisme
En milieu alcalin, le dibrome forme une l'espèce hypobromite, et l'azote de la fonction amide non substitué perd l'un de ses hydrogènes et devient porteur d'une charge négative. Le brome de l'hypobromite, porteur d'une charge partielle positive attaque ce dernier et forme un N-bromoamide. L'atome d'azote subit alors une seconde perte d'hydrogène. Contrairement aux réactions proches comme le réarrangement de Curtius, le réarrangement de Lossen ou encore la réaction de Schmidt (en), on n'observe pas après le départ du brome à la formation d'un intermédiaire qui serait ici un nitrène qui se réarrangerait ensuite en isocyanate, mais plutôt directement à un réarrangement concerté pour former immédiatement l'isocyanate. Ce dernier n'est pas stable en milieux aqueux et réagit immédiatement pour former un carbamate, qui se décarboxyle pour former l'amine et du dioxyde de carbone.(Nota Bene : cette réaction fonctionne aussi avec d'autres ions hypohalites comme l'ion hypochlorite .)
Variations
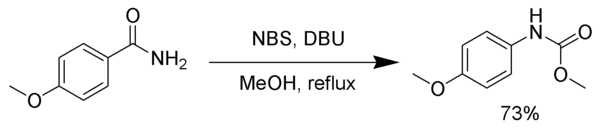
D'autres réactifs peuvent jouer le rôle du dibrome pour provoquer un réarrangement de Hofmann, comme le N-bromosuccinimide (NBS) ou le 1,8-diazabicyclo[5.4.0]undéc-7-ène (DBU). dans l'exemple suivant, l'intermédiaire isocyanate est piégé par le méthanol pour former un carbamate[4] :
De façon similaire, l'intermédiaire isocyanate peut être piégé par le tert-butanol.
Une alternative plus douce au dibrome peut aussi être le (bis(trifluoroacétoxy)iodo)benzène[5].
Applications
- Conversion des amides aliphatiques et aromatiques en amines correspondantes
- Préparation de l'acide anthranilique à partir du phtalimide.
- Conversion de l'acide nicotinique en 3-aminopyridine (en).
Bibliographie
- (en) J. Clayden, N. Greeves, S. Warren et P. Wothers, Organic Chemistry, Oxford University Press, , 1536 p. (ISBN 978-0-19-850346-0, présentation en ligne), p. 1073
- (en) L. F. Fieser et M. Fieser, Advanced Organic Chemistry, Reinhold Publishing Corporation, , 1158 p. (présentation en ligne), p. 499–501
Notes et références
- ↑ (de) A. W. Hofmann, « Ueber die Einwirkung des Broms in alkalischer Lösung auf Amide », Chem. Ber., vol. 14, no 2, , p. 2725-2736 (ISSN 0009-2940, DOI 10.1002/cber.188101402242, lire en ligne)
- ↑ (en) E. S. Wallis et J. F. Lane, « The Hofmann Reaction », Org. React., vol. 3, , p. 267-306 (ISBN 9780471005285, ISSN 0078-6179)
- ↑ (en) T. Shioiri, Comprehensive Organic Synthesis, vol. 4 : Additions to and Substitutions at C—C π-Bonds, Oxford, England/New York, Elsevier Science, (ISBN 978-0-08-052349-1, DOI 10.1016/B978-0-08-052349-1.00172-4, présentation en ligne), chap. 4 (« Degradation Reactions »), p. 795-828
- ↑ (en) J. W. Keillor et X. Huang, « Methyl Carbamate Formation via Modified Hofmann Rearrangement Reactions:Methyl N-(p-Methoxyphenyl)Carbamate », Org. Synth., vol. 78, , p. 234-236 (ISSN 0078-6209, lire en ligne)
- ↑ (en) M. R. Almond, J. B. Stimmel, E. A. Thompson et G. M. Loudon, « Hofmann Rearrangement under Mildly Acidic Conditions using [I,I-bis(Trifluoroacetoxy)]Iodobenzene: Cyclobutylamine Hydrochloride from Cyclobutantcarboxamide », Org. Synth., vol. 66, , p. 132 (ISSN 0078-6209, lire en ligne)
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Hofmann rearrangement » (voir la liste des auteurs).
Voir aussi
- Réarrangement de Beckmann
- Réarrangement de Curtius
- Réaction haloforme
- Réarrangement de Lossen
- Réaction de Schmidt
- Dégradation de Weerman
Lien externe
- (en) « Mechanism In Motion: Hofmann rearrangement »
 Portail de la chimie
Portail de la chimie