Ferredoxina

| ferredoxina 1 | |
|---|---|
 | |
| Gene | |
| HUGO | FDX1 FDX |
| Entrez | 2230 |
| Locus | Chr. 11 q22.3 |
| Proteina | |
| Numero CAS | 9040-09-9 |
| Modifica dati su Wikidata · Manuale | |
| ferredoxina 2 | |
|---|---|
| Gene | |
| HUGO | FDX2 |
| Entrez | 2143 |
| Proteina | |
| Numero CAS | 9040-09-9 |
| Modifica dati su Wikidata · Manuale | |
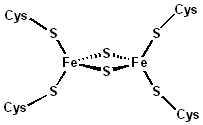
Le ferredoxine (spesso abbreviate come fd) sono proteine contenenti cluster ferro-zolfo in grado di mediare il trasferimento di elettroni in numerose reazioni metaboliche.
Il termine ferredoxina (dal latino ferrum (ferro) + redox, usato in italiano anche nella variante ferredossina) fu coniato da D.C. Wharton della DuPont, che lo usò per indicare la ferroproteina purificata nel 1962 da Mortenson, Valentine e Carnahan dal batterio anaerobico Clostridium pasteurianum.
Le ferredoxine possono essere classificate in base alla natura dei cluster ferro-zolfo che contengono o alla similarità di sequenza.
La ferredoxina del cloroplasto
Una particolare ferredoxina fu isolata a partire da cloroplasti di spinaci da Tagawa ed Arnon nel 1962. Tale proteina, chiamata ferredoxina di cloroplasto, è coinvolta nelle reazioni fotosintetiche di fotofosforilazione ciclica e non ciclica. Nella fotofosforilazione non ciclica, la ferredoxina è l'ultimo accettore di elettroni e riduce l'enzima ferredossina-NADP+ reduttasi. Essa accetta elettroni provenienti da molecole di clorofilla eccitate dalla luce solare, trasferendoli all'enzima.
Bibliografia
- Bruschi, M. and Guerlesquin, F., Structure, function and evolution of bacterial ferredoxins, in FEMS Microbiol. Rev., vol. 4, 1988, pp. 155–175, PMID 3078742.
- Ciurli, S. and Musiani, F., High potential iron-sulfur proteins and their role as soluble electron carriers in bacterial photosynthesis: tale of a discovery, in Photosynth. Res., vol. 85, 2005, pp. 115–131, DOI:10.1007/s11120-004-6556-4, PMID 15977063.
- Fukuyama, K., Structure and function of plant-type ferredoxins, in Photosynth. Res., vol. 81, 2004, pp. 289–301, DOI:10.1023/B:PRES.0000036882.19322.0a, PMID 16034533.
- Grinberg, A.V., Hannemann, F., Schiffler, B., Müller, J., Heinemann, U. and Bernhardt, R., <590::AID-PROT50>3.0.CO;2-P Adrenodoxin: structure, stability, and electron transfer properties, in Proteins, vol. 40, 2000, pp. 590–612, DOI:10.1002/1097-0134(20000901)40:4<590::AID-PROT50>3.0.CO;2-P, PMID 10899784.
- Holden,H.M., Jacobson, B.L., Hurley, J.K., Tollin, G., Oh, B.H., Skjeldal, L., Chae, Y.K., Cheng, H., Xia, B. and Markley, J.L., Structure-function studies of [2Fe-2S] ferredoxins, in J. Bioenerg. Biomembr., vol. 26, 1994, pp. 67–88, DOI:10.1007/BF00763220, PMID 8027024.
- Meyer, J., Ferredoxins of the third kind, in FEBS Lett., vol. 509, 2001, pp. 1–5, DOI:10.1016/S0014-5793(01)03049-6, PMID 11734195.
- Mortenson, L.E., Valentine, R.C. and Carnahan, J.E., An electron transport factor from Clostridium pasteurianum, in Biochem. Biophys. Res. Commun., vol. 7, 1962, pp. 448–452, DOI:10.1016/0006-291X(62)90333-9, PMID 14476372.
- Tagawa, K. and Arnon, D.I., Ferredoxins as electron carriers in photosynthesis and in the biological production and consumption of hydrogen gas, in Nature, vol. 195, 1962, pp. 537–543, DOI:10.1038/195537a0, PMID 14039612.
- Valentine, R.C., Bacterial ferredoxin, in Bacteriol Rev., vol. 28, 1964, pp. 497–517, PMID 14244728.
Altri progetti
Altri progetti
- Wikimedia Commons
 Wikimedia Commons contiene immagini o altri file su Ferredoxina
Wikimedia Commons contiene immagini o altri file su Ferredoxina
Collegamenti esterni
- (EN) IUPAC Gold Book, "ferredoxin", su goldbook.iupac.org.
| Controllo di autorità | GND (DE) 4154104-2 |
|---|
 Portale Biologia
Portale Biologia Portale Chimica
Portale Chimica










