Forza di Debye

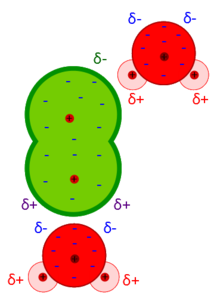
Le Forze di Debye sono forze intermolecolari risultanti dall'interazione di un dipolo permanente ed un dipolo indotto. Le forze di Debye fanno parte delle forze di van der Waals ed esprimono l'effetto d'induzione.
Dipolo indotto
Tutti gli atomi e molecole sono polarizzabili. Certi tipi di polarizzabilità risultano dalla deformazione della nuvola elettronica in presenza di un campo elettrico, che può essere esterno o generato da una molecola polare; il dipolo indotto viene definito come:
dove è la polarizzabilità della molecola ed è l'intensità del campo elettrico.
Interazione dipolo permanente-dipolo indotto
Molecola polare vs molecola apolare
Il potenziale d'interazione dipende dal momento dipolare della molecola polare (1).
Molecola polare vs molecola polare
In questo caso una molecola determina un dipolo indotto sull'altra molecola e viceversa. Il potenziale è definito come:
Voci correlate
- Forze di Van der Waals
- Forza di London
V · D · M | |
|---|---|
| Legami intramolecolari | Legame covalente (Legame di coordinazione · Legame σ · Legame π · Legame δ · Legame φ · Retrodonazione π · Antilegame · Legame a tre centri e due elettroni · Legame a quattro centri e due elettroni · Legame a tre centri e quattro elettroni · Legame metallico · Legame ionico |
| Legami intermolecolari | Legame a idrogeno · Legame ad alogeno · Forza di van der Waals · Forza di Debye · Forza di London · Interazione ione-solvente |
| Caratteristiche dei legami | Energia di legame · Lunghezza di legame |
| Teorie sui legami | Potenziale di Lennard-Jones · Regola dell'ottetto · Teoria di Kossel |
| Molteplicità dei legami | Legame singolo · Doppio legame · Triplo legame |
 Portale Meccanica
Portale Meccanica Portale Quantistica
Portale Quantistica


![{\displaystyle V=-{\frac {1}{r^{6}}}\left[{\frac {\mu _{1}^{2}\cdot \alpha _{2}}{(4\pi \cdot \varepsilon _{0}\cdot \varepsilon )^{2}}}\right]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/34453f7ec6b0f8be76b04bbdf69e397f6c0d06cf)
![{\displaystyle V=-{\frac {1}{r^{6}}}\left[{\frac {\mu _{1}^{2}\cdot \alpha _{2}+\mu _{2}^{2}\cdot \alpha _{1}}{(4\pi \cdot \varepsilon _{0}\cdot \varepsilon )^{2}}}\right]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c4526e1e9ebea5d44fac2540b2e1461569c9e77c)










