Triioduro
| Ione Triioduro | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| Triioduro | |
| Caratteristiche generali | |
| Formula bruta o molecolare | I3⁻ |
| Massa molecolare (u) | 380.71 g mol−1 |
| Numero CAS | N/A numero CAS non valido |
| PubChem | 105054 |
| SMILES | I[I-]I |
| Indicazioni di sicurezza | |
| Modifica dati su Wikidata · Manuale | |
Lo ione triioduro è un anione polialogenuro di formula I−3. Fa parte dei poliioduri ed è il più semplice di essi.
Viene preparato dissolvendo dei cristalli di iodio in una soluzione di ioduro (solitamente KI):
- I2 + I− → I−3
la reazione, che avviene in eccesso di I−, ha Keq= 710.
La reazione è di facile visualizzazione in quanto si ha un netto viraggio dall'incolore al giallo-bruno. Il colore dipende dalla concentrazione: le soluzioni diluite appaiono gialle, mentre aumentando la concentrazione diventano brune.
Struttura e legame

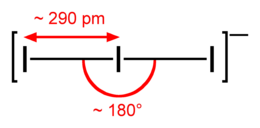
Lo ione è lineare e simmetrico. Secondo la teoria VSEPR, l'atomo centrale ha 3 lone pairs equatoriali, e gli atomi terminali sono legati assialmente in forma lineare, dovuto ai tre lone pairs legati all'atomo centrale. Nel modello orbitale molecolare, viene spiegato il legame ipervalente sull'atomo centrale come un legame a 4-elettroni a tre centri. Il legame I−I è più lungo dello Iodio diatomico, I2. Infatti le misure spettroscopiche hanno confermato che la molecola è lineare e planare. Le distanze di legame I−I variano tra 280 e 310 pm a seconda del catione e sono generalmente diverse all'interno della stessa molecola che può quindi essere indicata come Ia−Ib−Ic. Queste variazioni sono riassunte in tabella:
| composto | Ia−Ib (pm) | Ib - Ic (pm) | angolo (°) |
|---|---|---|---|
| TlI3 | 306,3 | 282,6 | 177,9 |
| RbI3 | 305,1 | 283,3 | 178,11 |
| CsI3 | 303,8 | 284,2 | 178,00 |
| NH4I3 | 311,4 | 279,7 | 178,55 |
Usi del triioduro
Il triioduro ha numerose applicazioni in quanto costituisce la forma idrosolubile dello iodio, le soluzioni di I−3 hanno una reattività analoga all'I2. In chimica analitica le soluzioni di triioduro o la formazione di esso in situ sono sfruttate rispettivamente nella iodimetria e nella iodometria.
In biologia le soluzioni di triioduro prendono il nome di reattivo di Lugol utilizzato come colorante e per riconoscere la presenza di amido (si forma un complesso di colore blu intenso).
La tintura di iodio è una soluzione idroalcolica al 3% di triioduro.
Bibliografia
- N. N. Greenwood, A. Earnshaw. Chimica degli elementi, Vol II. Piccin. ISBN 88-299-1121-6
- I. Bertini, F. Mani. Chimica Inorganica. CEDAM. ISBN 88-13-16199-9
Altri progetti
Altri progetti
- Wikimedia Commons
 Wikimedia Commons contiene immagini o altri file su Triioduro
Wikimedia Commons contiene immagini o altri file su Triioduro
 Portale Chimica: il portale della scienza della composizione, delle proprietà e delle trasformazioni della materia
Portale Chimica: il portale della scienza della composizione, delle proprietà e delle trasformazioni della materia












