Bindingshoek
| Chemische binding |
|---|
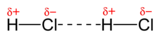 |
| Dipool-dipoolinteracties |
Moleculen (intramoleculair)
Moleculen (intermoleculair)
Zouten
Metalen
Covalente netwerken
Theorieën
Eigenschappen
|
Portaal  Scheikunde Scheikunde |
De bindingshoek is een hoek die gevormd wordt door twee bindingen op eenzelfde atoom. Zij kunnen berekend worden aan de hand van de VSEPR-theorie. In veel gevallen wijkt de werkelijke hoek soms veel, soms weinig af van de ideale waarde. Zo verschilt de bindingshoek in waterstofsulfide (92°) veel meer van de ideale tetraëdrische bindingshoek (109°) dan die in water (104,5°). Bindingshoeken geven informatie over de energieniveaus in moleculen en daarmee ook over reactiemogelijkheden en stabiliteit.
| AXE-symbool | B. p. | V. p. | Moleculaire geometrie | Hoek(en) | Voorbeeld | Structuur |
|---|---|---|---|---|---|---|
| AX2E0 | 2 | 0 | lineair | 180° | BeCl2 |  |
| AX3E0 | 3 | 0 | trigonaal planair | 120° | BF3 |  |
| AX2E1 | 2 | 1 | geknikt | < 120° | SO2 |  |
| AX4E0 | 4 | 0 | tetraëder | 109,5° | CH4 |  |
| AX3E1 | 3 | 1 | trigonale piramide | 107° < 109,5˚ | NH3 |  |
| AX2E2 | 2 | 2 | gebogen | 105˚< 109,5˚ | H2O |  |
| AX5E0 | 5 | 0 | trigonale bipiramide | 90°, 120° | PCl5 |  |
| AX4E1 | 4 | 1 | seesaw | 90°, 120°, 180° | SF4 |  |
| AX3E2 | 3 | 2 | T-vormig | 90°, 180° | ClF3 |  |
| AX2E3 | 2 | 3 | lineair | 180° | XeF2 |  |
| AX6E0 | 6 | 0 | octaëder | 90° | SF6 |  |
| AX5E1 | 5 | 1 | vierkante piramide | 90° | BrF5 |  |
| AX4E2 | 4 | 2 | vierkant planair | 90° | PtCl4 |  |
| AX5E2 | 5 | 2 | pentagonaal planair | 72° | XeF5- |  |
| AX6E1 | 6 | 1 | pentagonale piramide | 90°, 72° | IOF52− |  |
| AX7E0 | 7 | 0 | pentagonale bipiramide | 90°, 72° | IF7 |  |










