Calmoduline
| Calmoduline | ||||
|---|---|---|---|---|
 | ||||
Calmoduline verandert van conformatie na binding met calcium (rechts). Bindingsplaatsen bij sterretjes. | ||||
| Eigenschappen | ||||
| Molecuulmassa en lengte | 16.7 kDa (148 aminozuren) | |||
| Identificatie | ||||
| Symbool | CaM | |||
| PDB-codes | 1OSA | |||
| Externe identificaties | ||||
| UniProt | P62158 | |||
| ||||
Calmoduline (CaM) (kort voor calcium modulated protein) is een multifunctioneel, calcium-bindend eiwit dat tot expressie komt in de cellen van vrijwel alle eukaryote levensvormen.[1] Calmoduline wordt geactiveerd door binding van Ca2+. Calcium is een belangrijke second messenger, die vrijkomt onder invloed van extracellulaire signaalmoleculen. Het is in staat interacties aan te gaan met verschillende andere eiwitten, zoals kinases, om zo een signaal binnen de cel door te geven.[2]
Calmodulin is een klein, sterk geconserveerd eiwit met een lengte van 148 aminozuren (16,7 kDa). Het eiwit bestaat uit twee symmetrische globulaire uiteinden, die elk een gepaard motief bevatten (het zogenaamde EF-handmotief), gescheiden door een flexibele linker.[3] In totaal zijn er vier bindingsplaatsen voor calciumionen. Wanneer calcium deze vier bindingsplaatsen bezet, zal calmoduline zijn actieve conformatie aannemen. De hydrofobe residuen komen bloot te liggen en zullen via hydrofobe interacties binden aan doeleiwitten.
Calmoduline speelt in dieren een belangrijke rol in vele cellulaire processen, zoals stofwisseling, apoptose, contractie van spiercellen, intracellulaire bewegingen, ontstekingsreacties en de immuunrespons.[4][5] Calcium is een centraal onderdeel binnen het intracellulair signaleringssysteem; het diffundeert snel door het cytosol als reactie op initiële stimuli. Veruit het belangrijkste calcium-bindende eiwit dat de signaaltransductie voortzet is calmoduline. Het vertegenwoordigt soms wel 1% van de totale eiwitmassa in de cel.
Structuur
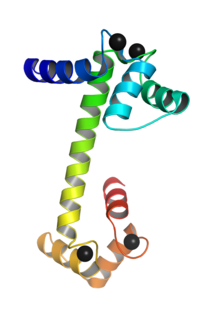
Calmoduline bestaat uit een sterk geconserveerde, enkele polypeptideketen met vier bindingsplaatsen voor Ca2+ (calciumionen).[6] Calmoduline is relatief klein en telt 148 aminozuren. De tertiaire structuur van het eiwit is te vergelijken met een handhalter: het heeft twee globulaire (bolvormige) uiteinden die gescheiden worden door een lange α-helix, een zogenaamde flexibele linker. Deze linker geeft het eiwit een enorme bewegingsvrijheid; het stelt het eiwit in staat om aan meer dan 300 verschillende doeleiwitten te binden, door de globulaire domeinen om een target-peptide heen te buigen.[7]
Wanneer Ca2+-ionen zich aan calmoduline binden, ondergaat het eiwit een conformatieverandering. Omdat er twee of vier calciumionen moeten binden voordat calmoduline zijn actieve conformatie aanneemt, is de respons van dit eiwit te beschrijven als een sigmoïdefunctie bij toenemende Ca2+-concentratie. Calmoduline kan zich op uiteenlopende manieren binden aan doeleiwitten. Meestal is de binding het gevolg van hydrofobe interacties, wat toelaat dat calmoduline niet beperkt is tot de herkenning van zeer specifieke aminozuursequenties.[8][9][10]
Fysiologische rol
In dieren
Calmoduline speelt een regulerende rol in verscheidene cellulaire processen, zoals stofwisseling, apoptose, contractie van het glad spierweefsel, intracellulaire bewegingsprocessen, ontstekingsreacties en de immuunrespons. Calmoduline wordt in veel celtypen tot expressie gebracht en is soms sterk gelokaliseerd, bijvoorbeeld in het cytoplasma, in organellen. Het kan zich ook associëren met het plasmamembraan. Calmoduline komt uitsluitend intracellulair voor. Hoewel er veel eiwitten zijn calcium kunnen binden en betrokken zijn in de calciumsignaaltransductie, is calmoduline door zijn veelzijdigheid veruit het belangrijkst. Extracellulaire stimuli kunnen een signaalroute in gang zetten waarbij Ca2+ vrijkomt, bijvoorbeeld uit het endoplasmatisch reticulum (een opslagplaats voor Ca2+). De gestegen Ca2+-niveaus leiden ertoe dat calmoduline geactiveerd wordt, om vervolgens de activiteit van andere eiwitten te reguleren. Om deze reden wordt calmoduline ook wel beschouwd als een calciumsensor.[6]
Zie ook
Referenties
Literatuur
|











