Izotiocijanat

Izotiocijanat je hemijska grupa –N=C=S, formirana supstitucijom kiseonika u izocijanatnoj grupi sumporom.[1] Mnogi prirodni biljni izotiocijnati se formiraju enzimskom konverzijom glukozinolata. Prirodini izotiocijanati, poput alil izotiocijanata, su takođe poznati kao ulje semfa. Veštački izotiocijanat, fenil izotiocijanat, se korisiti za sekvenciranje aminokiselina u Edmanovoj degradaciji.[2]
Sinteza i reakcije
Opšti metod za formiranje izotiocijanata se sastoji od reakcije između primarnog amina (e.g. anilina) i ugljen disulfida u vodenom rastvoru amonijaka. Dolazi do precipitacije amonijum ditiokarbamatne soli, koja se zatim treatira olovo nitratom da bi se formirao izotiocijanat.[3] Jedan alternativni metod je zasnovan na tosil hloridom posredovanoj dekompoziciji ditiokarbamatnih soli koje se stravaraju u prvom koraku prethodnog postupka.[4]

Sinteza fenil izotiocijanata
Izotiocijanati se takođe mogu formirati putem termički indukovanih fragmentacinih reakcija 1,4,2-oksatiazola.[5] Ova sintetička metodologija je korištena pri polimerno podržanoj sintezi izotiocijanata.[6]
Izotiocijanati su slabi elektrofili. Slično reakcijama ugljen dioksida, nukleofili napadaju ugljenik.
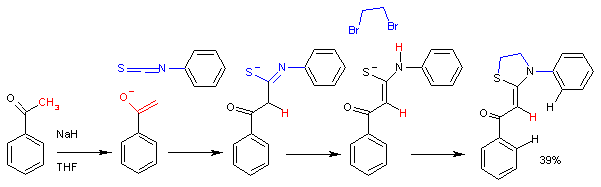
Reakcija acetofenon enolata sa fenil izotiocijanatom.
U ovoj sintezi[7] ultimatni reakcioni produkt je tiazolidin. Reakcija je stereosektivna, te se formira samo Z-izomer.
Usled njihovog elektrofilnog karaktera, izotiocijanati su podložni hidrolizi.
Reference
- ↑ Clayden Jonathan, Nick Greeves, Stuart Warren, Peter Wothers (2001). Organic chemistry. Oxford, Oxfordshire: Oxford University Press. ISBN 0-19-850346-6.
- ↑ Edman, P.; Högfeldt, Erik; Sillén, Lars Gunnar; Kinell, Per-Olof (1950). „Method for determination of the amino acid sequence in peptides”. Acta Chem. Scand. 4: 283–293. DOI:10.3891/acta.chem.scand.04-0283.
- ↑ Dains FB; Brewster RQ; Olander CP (1926), „Phenyl Isothiocyanate”, Organic Syntheses 6: 72 ; Coll. Vol. 1: 447
- ↑ Wong, R; Dolman, SJ (2007). „Isothiocyanates from tosyl chloride mediated decomposition of in situ generated dithiocarbamic acid salts”. The Journal of Organic Chemistry 72 (10): 3969–3971. DOI:10.1021/jo070246n. PMID 17444687.
- ↑ O’Reilly, RJ; Radom, L (2009). „Ab initio investigation of the fragmentation of 5,5-diamino-substituted 1,4,2-oxathiazoles”. Organic Letters 11 (6): 1325–1328. DOI:10.1021/ol900109b. PMID 19245242.
- ↑ Burkett, BA; Kane-Barber, JM; O’Reilly, RJ; Shi, L (2007). „Polymer-supported thiobenzophenone : a self-indicating traceless 'catch and release' linker for the synthesis of isothiocyanates”. Tetrahedron Letters 48 (31): 5355–5358. DOI:10.1016/j.tetlet.2007.06.025.
- ↑ Ortega-Alfaro, M. C.; López-Cortés, J. G.; Sánchez, H. R.; Toscano, R. A.; Carrillo, G. P.; Álvarez-Toledano, C. (2005). „Improved approaches in the synthesis of new 2-(1, 3-thiazolidin-2Z-ylidene)acetophenones”. Arkivoc 2005 (6): 356–365.
Vidi još
- Metilizotiocijanat
- p
- r
- u
Alkohol • Aldehid • Alkan • Alken • Alkin • Amid • Amidin • Amin • Azo jedinjenje • Derivat benzena • Karboksil • Cijanat • Disulfid • Estar • Etar • Haloalkan • Hidrazon • Imid • Imin • Izocijanid • Izocijanat • Izonitril • Izotiocijanat • Karbamat • Keton • Organofosfor • Oksim • Nitril • Nitro • Nitrozo • Peroksid • Fosfonit • Fosfonat • Derivat piridina • Sulfon • Sulfonska kiselina • Sulfoksid • Tiocijanat • Tioestar • Tioetar • Tiol








