Kalcijum hipohlorit
| Kalcijum hipohlorit | |||
|---|---|---|---|
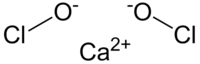 | |||
| Drugi nazivi | Hipohlorna kiselina, kalcijumova so Prah za izbeljavanje | ||
| Identifikacija | |||
| CAS registarski broj | 7778-54-3  Y Y | ||
| ChemSpider[1] | 22912  Y Y | ||
| EINECS broj | 231-908-7 | ||
| UN broj | 1748 | ||
| RTECS registarski broj toksičnosti | NH3485000 | ||
| Jmol-3D slike | Slika 1 | ||
| |||
| |||
| Svojstva | |||
| Molekulska formula | Ca(ClO)2 | ||
| Molarna masa | 142.98 g/mol | ||
| Agregatno stanje | beli/sivi prah | ||
| Gustina | 2.35 g/cm3 (20 °C) | ||
| Tačka topljenja | 100 °C | ||
| Tačka ključanja | 175 °C, razlaže se | ||
| Rastvorljivost u vodi | 21 g/100 mL, reaguje | ||
| Rastvorljivost | reaguje u alkoholu | ||
| Opasnost | |||
| Podaci o bezbednosti prilikom rukovanja (MSDS) | ICSC 0638 | ||
| EU-klasifikacija | Oksidans (O) Korozivan je (C) Štetan (Xn) Opasan po životnu sredinu (N) | ||
| EU-indeks | 017-012-00-7 | ||
| NFPA 704 |  0 3 1 OX | ||
| R-oznake | R8, R22, R31, R34, R50 | ||
| S-oznake | (S1/2), S26, S36/37/39, S45, S61 | ||
| Tačka paljenja | Nije zapaljiv | ||
| LD50 | 850 mg/kg (oralno, pacov) | ||
| Srodna jedinjenja | |||
| Drugi anjoni | Kalcijum hlorid | ||
| Drugi katjoni | Natrijum hipohlorit | ||
| Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje (25 °C, 100 kPa) materijala | |||
| Infobox references | |||
Kalcijum hipohlorit je hemijsko jedinjenje sa formulom Ca(ClO)2. On se koristi za tretman vode, i kao izbeljivač (prah za izbeljivanje). Smatra se da je ova hemikalija relativno stabilna, i da ima dostupniji hlor nego natrijum hipohlorit (tečni izbeljivač).
Priprema
On se proizvodi kalcijumskim procesom:
- .
Prah za izbeljivanje je zapravo smeša kalcijum hipohlorita (Ca(ClO)2) i običnog hlorida CaCl2, H2O sa primesama ugašenog kreča, Ca(OH)2.[2]
Osobine
Kalcijum hipohlorit je žuto beli prah koji ima jak miris hlora. On nije jako rastvoran u vodi, i preferentno se koristi u mekoj do srednje tvrde vode. Postoje dve forme: suva i hidratisana forma. Hidratisana forma je bezbednija za rukovanje.
Kalcijum hipohlorit reaguje sa ugljen dioksidom da formira kalcijum karbonat, čime se oslobađa dihlor monoksid:
- .
Kalcijum hipohlorit reaguje sa hlorovodoničnom kiselinom da formira kalcijum hlorid:
- Ca(ClO)2 + 4 HCl → CaCl2 + 2 H2O + 2 Cl2
Reference
- ↑ Hettne KM, Williams AJ, van Mulligen EM, Kleinjans J, Tkachenko V, Kors JA. (2010). „Automatic vs. manual curation of a multi-source chemical dictionary: the impact on text mining”. J Cheminform 2 (1): 3. DOI:10.1186/1758-2946-2-3. PMID 20331846. edit
- ↑ Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, ISBN 0-07-049439-8
- p
- r
- u










