Myc
| edit |
| V-myc mielocitomatozni viralni onkogenski homolog | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
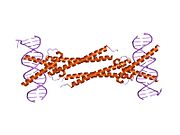
 Struktura c-Myc (crveno) u kompleksu sa Max (plavo) i DNK (1nkp). Oba proteina su vezana za veliki žleb DNK čime formiraju strukturu sličnu račvi. | |||||||||||
| Dostupne strukture | |||||||||||
| 1A93, 1EE4, 1MV0, 1NKP, 2A93 | |||||||||||
| Identifikatori | |||||||||||
| Simboli | MYC; MRTL; bHLHe39; c-Myc | ||||||||||
| Vanjski ID | OMIM: 190080 MGI: 97250 HomoloGene: 31092 GeneCards: MYC Gene | ||||||||||
| |||||||||||
| Ortolozi | |||||||||||
| Vrsta | Čovek | Miš | |||||||||
| Entrez | 4609 | 17869 | |||||||||
| Ensembl | ENSG00000136997 | ENSMUSG00000022346 | |||||||||
| UniProt | P01106 | P01108 | |||||||||
| RefSeq (mRNA) | NM_002467.4 | NM_001177352.1 | |||||||||
| RefSeq (protein) | NP_002458.2 | NP_001170823.1 | |||||||||
| Lokacija (UCSC) | Chr 8: 128.75 - 128.75 Mb | Chr 15: 61.82 - 61.82 Mb | |||||||||
| PubMed pretraga | [1] | [2] | |||||||||
Myc (c-Myc) je regulatorni gen koji kodira transkripcioni faktor.
Mutirane verzije Myc gena su nađene u mnoštvu tipova kancera. One uzrokuju konstitutivnu (perzistentnu) ekspresiju gena. To dovodi do umanjenog izražavanja mnoštva gena, neki od kojih učestvuju u ćelijskoj proliferaciji, i time se formira kancer. Česta translokacija koja obuhvata Myc je t(8;14). Ona je kritična za razvoj u mnogim slučajevima Burkitovog limfoma. Nedavna istraživanja demonstriraju da privremena inhibicija Myc faktora selektivno ubija ćelije kancera pluća kod miševa, te je stoga ovaj protein potencijalni cilj za lekove protiv kancera.[1]
U humanom genomu, Myc je lociran na hromozomu 8 i smatra se da reguliše izražavanje 15% svih gena[2] putem vezivanja za sekvencu pojačivačke kutije (E-kutija) i regrutovanja histonske acetiltransferaze (HAT). To znači da osim njegove uloge klasičnog transkripcionog faktora, Myc takođe deluje kao globalni regulator hromatinske strukture putem regulacije histonske acetilacije u regionima bogatim genima, kao i na mestima udaljenim od poznatih gena.[3]
Reference
- ↑ Soucek L, Whitfield J, Martins CP, Finch AJ, Murphy DJ, Sodir NM, Karnezis AN, Swigart LB, Nasi S, Evan GI (October 2008). „Modelling Myc inhibition as a cancer therapy”. Nature 455 (7213): 679–83. DOI:10.1038/nature07260. PMID 18716624.
- ↑ Gearhart J, Pashos EE, Prasad MK, Pluripotency Redeux -- advances in stem-cell research, N Engl J Med 357(15):1469 Free full text Arhivirano 2008-10-19 na Wayback Machine-u
- ↑ Cotterman R, Jin VX, Krig SR, Lemen JM, Wey A, Farnham PJ, Knoepfler PS. (2008). „N-Myc regulates a widespread euchromatic program in the human genome partially independent of its role as a classical transcription factor”. Cancer Res. 68 (23): 9654–62. DOI:10.1158/0008-5472.CAN-08-1961. PMC 2637654. PMID 19047142.
Literatura
- Ruf IK, Rhyne PW, Yang H, et al. (2002). „EBV regulates c-MYC, apoptosis, and tumorigenicity in Burkitt's lymphoma”. Curr. Top. Microbiol. Immunol. 258: 153–60. PMID 11443860.
- Lüscher B (2001). „Function and regulation of the transcription factors of the Myc/Max/Mad network”. Gene 277 (1–2): 1–14. DOI:10.1016/S0378-1119(01)00697-7. PMID 11602341.
- Hoffman B, Amanullah A, Shafarenko M, Liebermann DA (2002). „The proto-oncogene c-myc in hematopoietic development and leukemogenesis”. Oncogene 21 (21): 3414–21. DOI:10.1038/sj.onc.1205400. PMID 12032779.
- Pelengaris S, Khan M, Evan G (2002). „c-MYC: more than just a matter of life and death”. Nat. Rev. Cancer 2 (10): 764–76. DOI:10.1038/nrc904. PMID 12360279.
- Nilsson JA, Cleveland JL (2004). „Myc pathways provoking cell suicide and cancer”. Oncogene 22 (56): 9007–21. DOI:10.1038/sj.onc.1207261. PMID 14663479.
- Dang CV, O'donnell KA, Juopperi T (2005). „The great MYC escape in tumorigenesis”. Cancer Cell 8 (3): 177–8. DOI:10.1016/j.ccr.2005.08.005. PMID 16169462.
- Dang CV, Li F, Lee LA (2007). „Could MYC induction of mitochondrial biogenesis be linked to ROS production and genomic instability?”. Cell Cycle 4 (11): 1465–6. DOI:10.4161/cc.4.11.2121. PMID 16205115.
- Coller HA, Forman JJ, Legesse-Miller A (2007). „"Myc'ed Messages": Myc Induces Transcription of E2F1 while Inhibiting Its Translation via a microRNA Polycistron”. PLoS Genet. 3 (8): e146. DOI:10.1371/journal.pgen.0030146. PMC 1959363. PMID 17784791.
- Astrin SM, Laurence J (1992). „Human immunodeficiency virus activates c-myc and Epstein-Barr virus in human B lymphocytes”. Ann. N. Y. Acad. Sci. 651: 422–32. DOI:10.1111/j.1749-6632.1992.tb24642.x. PMID 1318011.
- Bernstein PL, Herrick DJ, Prokipcak RD, Ross J (1992). „Control of c-myc mRNA half-life in vitro by a protein capable of binding to a coding region stability determinant”. Genes Dev. 6 (4): 642–54. DOI:10.1101/gad.6.4.642. PMID 1559612.
- Iijima S, Teraoka H, Date T, Tsukada K (1992). „DNA-activated protein kinase in Raji Burkitt's lymphoma cells. Phosphorylation of c-Myc oncoprotein”. Eur. J. Biochem. 206 (2): 595–603. DOI:10.1111/j.1432-1033.1992.tb16964.x. PMID 1597196.
- Seth A, Alvarez E, Gupta S, Davis RJ (1992). „A phosphorylation site located in the NH2-terminal domain of c-Myc increases transactivation of gene expression”. J. Biol. Chem. 266 (35): 23521–4. PMID 1748630.
- Takahashi E, Hori T, O'Connell P, et al. (1991). „Mapping of the MYC gene to band 8q24.12----q24.13 by R-banding and distal to fra(8)(q24.11), FRA8E, by fluorescence in situ hybridization”. Cytogenet. Cell Genet. 57 (2–3): 109–11. DOI:10.1159/000133124. PMID 1914517.
- Blackwood EM, Eisenman RN (1991). „Max: a helix-loop-helix zipper protein that forms a sequence-specific DNA-binding complex with Myc”. Science 251 (4998): 1211–7. DOI:10.1126/science.2006410. PMID 2006410.
- Gazin C, Rigolet M, Briand JP, et al. (1986). „Immunochemical detection of proteins related to the human c-myc exon 1”. EMBO J. 5 (9): 2241–50. PMC 1167107. PMID 2430795.
- Lüscher B, Kuenzel EA, Krebs EG, Eisenman RN (1989). „Myc oncoproteins are phosphorylated by casein kinase II”. EMBO J. 8 (4): 1111–9. PMC 400922. PMID 2663470.
- Finver SN, Nishikura K, Finger LR, et al. (1988). „Sequence analysis of the MYC oncogene involved in the t(8;14)(q24;q11) chromosome translocation in a human leukemia T-cell line indicates that putative regulatory regions are not altered”. Proc. Natl. Acad. Sci. U.S.A. 85 (9): 3052–6. DOI:10.1073/pnas.85.9.3052. PMC 280141. PMID 2834731.
- Showe LC, Moore RC, Erikson J, Croce CM (1987). „MYC oncogene involved in a t(8;22) chromosome translocation is not altered in its putative regulatory regions”. Proc. Natl. Acad. Sci. U.S.A. 84 (9): 2824–8. DOI:10.1073/pnas.84.9.2824. PMC 304752. PMID 3033665.
- Guilhot S, Petridou B, Syed-Hussain S, Galibert F (1989). „Nucleotide sequence 3' to the human c-myc oncogene; presence of a long inverted repeat”. Gene 72 (1–2): 105–8. DOI:10.1016/0378-1119(88)90131-X. PMID 3243428.
- Hann SR, King MW, Bentley DL, et al. (1988). „A non-AUG translational initiation in c-myc exon 1 generates an N-terminally distinct protein whose synthesis is disrupted in Burkitt's lymphomas”. Cell 52 (2): 185–95. DOI:10.1016/0092-8674(88)90507-7. PMID 3277717.
Spoljašnje veze
- Myc protein
- Ljudski Myc protein
- p
- r
- u
|