Fosfat
 | |||
| |||
| Nazivi | |||
|---|---|---|---|
| Sistemski IUPAC naziv Fosfat[1] | |||
| Identifikacija | |||
| |||
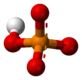
3D model (Jmol) |
| ||
| Bajlštajn | 3903772 | ||
| ChEBI |
| ||
| ChemSpider |
| ||
| Gmelin Referenca | 1997 | ||
| MeSH | Phosphates | ||
| |||
| UNII |
| ||
SMILES
| |||
| Svojstva | |||
| PO43− | |||
| Molarna masa | 94,9714 g mol−1 | ||
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje materijala (na 25 °C [77 °F], 100 kPa). | |||
 Y verifikuj (šta je Y verifikuj (šta je  Y Y Н ?) Н ?) | |||
| Reference infokutije | |||


Fosfat, je u neorganskoj hemiji so fosforne kiseline. U organskoj hemiji, fosfat, ili organofosfat, je estar fosforne kiseline. Organski fosfati su važni u biohemiji i biogeohemiji ili ekologiji. Neorganiski fosfati se iskopavaju da bi se dobio fosfor za upotrebu u agrikulturi i industriji.[5][6][7] Na povišenim temperaturama u čvrstom stanju, fosfati mogu da se kondenzuju i formiraju pirofosfate.
Hemijske osobine
Fosfatni jon je poliatomski jon sa empirijskom formulom PO43− i molarnom masom od 94.973 g/mol. On se sastoji od jednog centralnog atoma fosfora atom okruženog sa četiri atoma kiseonika u tetraedarskoj konfiguraciji. Fosfatni jon nosi tri negativa formalna naelektrisanja i on je konjugovana baza hidrogen fosfatnog jona, HPO42-, koji je konjugovana baza H2PO4-, dihidrogen fosfatnog jona, koji je konjugovana baza H3PO4, fosforne kiseline. On je hipervalentni molekul (atom fosfora ima 10 elektrona u svojoj valentnoj ljuski). Fosfat je takođe organofosforno jedinjenje sa formulom OP(OR)3.
Fosfatne soli se formiraju kad se pozitivno-naelektrisani jon veže za negativno-naelektrisane atome kiseonika, formirajući jonsko jedinjenje. Mnogi fosfati nisu rastvorni u vodi na standardnoj temperaturi i pritisku. Natrijum, kalijum, rubidijum, cezijum i amonijum fosfati su rastvorni u vodi. Većina drugih fosfata su veoma malo rastvorni ili nerastvorni u vodi. Kao pravilo, hidrogen i dihidrogen fosfati su nešto rastvorniji od korespondirajućih fosfata. Pirofosfati su uglavnom rastvorni u vodi.
U razređenim vodenim rastvorima, fosfat postoji u četiri oblika. U jako-baznoj sredini, fosfatni jon (PO43−) predominira, dok u slabo-baznim uslovima, hidrogen fosfatni jon (HPO42−) je prevalentan. U slabo-kiselim uslovima, dihidrogen fosfatni jon (H2PO4−) je najzastupljeniji. U jako-kiseloj sredini, fosforna kiselina (H3PO4) je glavna forma.
-

H3PO4 -

H2PO4− -
HPO42− -

PO43−
Precizniji, polazeći od sledeće tri ravnotežne reakcije:
- H3PO4 ⇌ H+ + H2PO4−
- H2PO4− ⇌ H+ + HPO42−
- HPO42− ⇌ H+ + PO43−
korespondirajuće konstante disocijacije na 25 °C (u mol/L) su:
- (pKa1 2.12)
- (pKa2 7.21)
- (pKa3 12.67)
Reference
- ^ „Phosphates – PubChem Public Chemical Database”. The PubChem Project. USA: National Center of Biotechnology Information.
- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003. уреди
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ Campbell, Neil A.; Reece, Jane B. (2005). Biology (Seventh изд.). San Francisco, California: Benjamin Cummings. стр. 65. ISBN 978-0-8053-7171-0.
- ^ „Phosphate Primer”. Архивирано из оригинала 20. 06. 2008. г. Приступљено 17. 10. 2010.
- ^ Lynn A. Kuntz (2006). „Figuring Out Phosphates”. Архивирано из оригинала 20. 12. 2008. г. Приступљено 17. 10. 2010.
- ^ Kuntz, Lynn A. (2006). „Food Product Design”. Архивирано из оригинала 20. 12. 2008. г. Приступљено 17. 10. 2010.
Spoljašnje veze
- п
- р
- у






![{\displaystyle K_{a1}={\frac {[{\mbox{H}}^{+}][{\mbox{H}}_{2}{\mbox{PO}}_{4}^{-}]}{[{\mbox{H}}_{3}{\mbox{PO}}_{4}]}}\simeq 7.5\times 10^{-3}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7e81fc5d22c187e5acc19c15b8422a604474b916)
![{\displaystyle K_{a2}={\frac {[{\mbox{H}}^{+}][{\mbox{HPO}}_{4}^{2-}]}{[{\mbox{H}}_{2}{\mbox{PO}}_{4}^{-}]}}\simeq 6.2\times 10^{-8}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c10e3502ce38d504ebf659f7411f2d2f24015c25)
![{\displaystyle K_{a3}={\frac {[{\mbox{H}}^{+}][{\mbox{PO}}_{4}^{3-}]}{[{\mbox{HPO}}_{4}^{2-}]}}\simeq 2.14\times 10^{-13}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/42097ca31fd0468791802af675f407bda4e4c871)











